L'œil contient des informations
« L’âme, heureusement, a un interprète - souvent inconscient mais toujours un interprète fidèle - dans les yeux. » - Charlotte Bronte
Plus ou moins consciemment, nous lisons beaucoup dans le regard d'autrui. Mais à une échelle macroscopique et avec l'aide de l'intelligence artificielle cette lecture est stupéfiante. L'oeil est désormais une fenêtre sur la santé d'un patient dans son ensemble.
L’iridologie était plutôt perçue comme une discipline de médecine alternative et donc jugée peu crédible. Cette méthode diagnostic basée sur l’analyse de l’iris, de sa structure, ses particularités, la variation de sa pigmentation, etc. Les Allemands étaient les plus ouverts sur le sujet, depuis bien longtemps. Le dépistage irien permettait une distinction essentielle entre la santé ”clinique”, l’état physiologique actuel du patient, et la santé ”constitutionnelle”, imputable à son entité génétique et familiale, décelant les faiblesses fonctionnelles, les défaillances organiques.
Cette approche d’analyse sémiologique sérieuse, était donc préventive.
Nous savions déjà que l’examen des yeux révèle des informations sur la santé générale: en 1898, l’ophtalmologiste écossais Marcus Gunn a montré que les changements dans les vaisseaux sanguins rétiniens pouvaient indiquer une hypertension. Aujourd’hui, cependant, la nouvelle discipline oculomics a prouvé que les yeux peuvent révéler une quantité extraordinaire d’informations sur la santé systémique d’une personne.
L'oculomics, c'est le décryptage complet de l’oclomée en intégrant les informations générées par l’imagerie multimodale visant à identifier les biomarqueurs ophtalmiques spécifiques des maladies systémiques.
La nouvelle discipline a vue le jour par accident pourrait-on dire. Ce champs de recherche est exécuté en grande partie par l'intelligence artificielle. Ce système apprend et progresse, pour détecter les biomarqueurs de la santé systémique dans l’œil.
Google a racheté Deep Mind un processus de calcule ultra puissant, afin de mettre au point un outils de diagnostique dans le but de rivaliser avec les plus grands médecins et chercheurs.
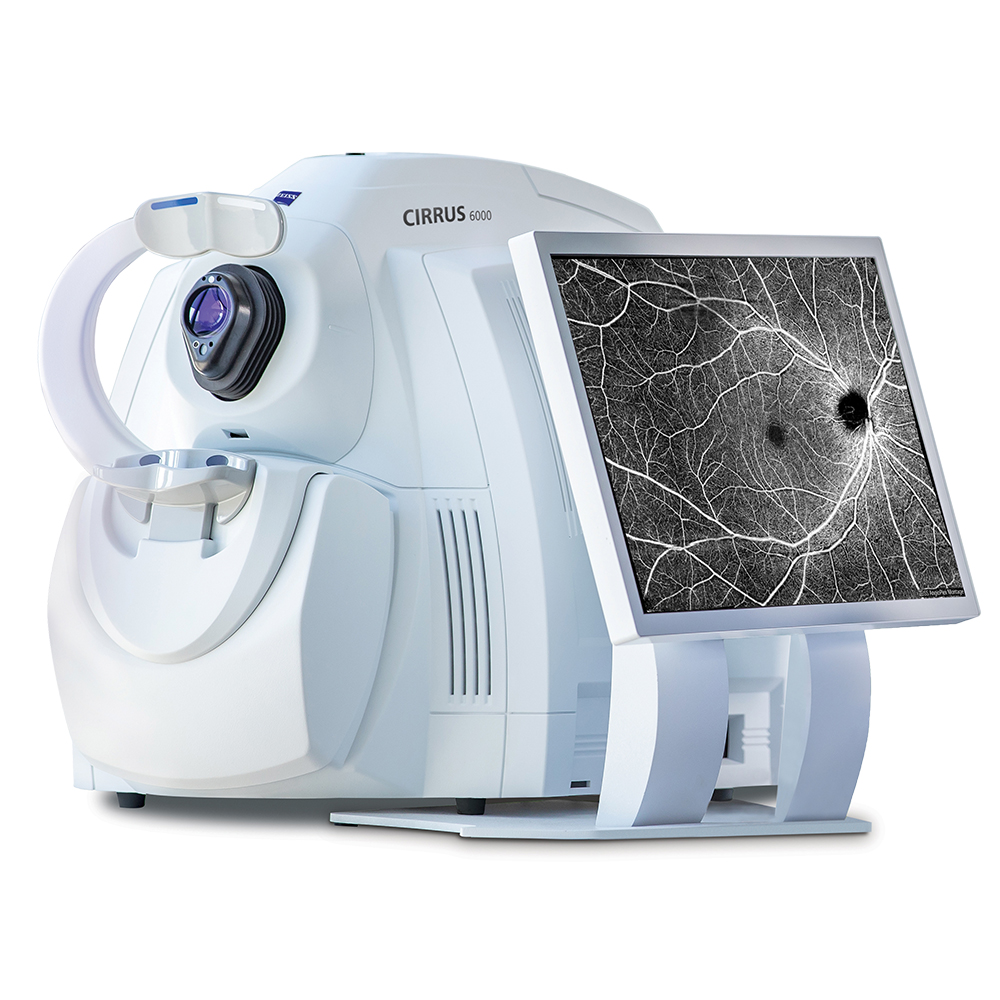
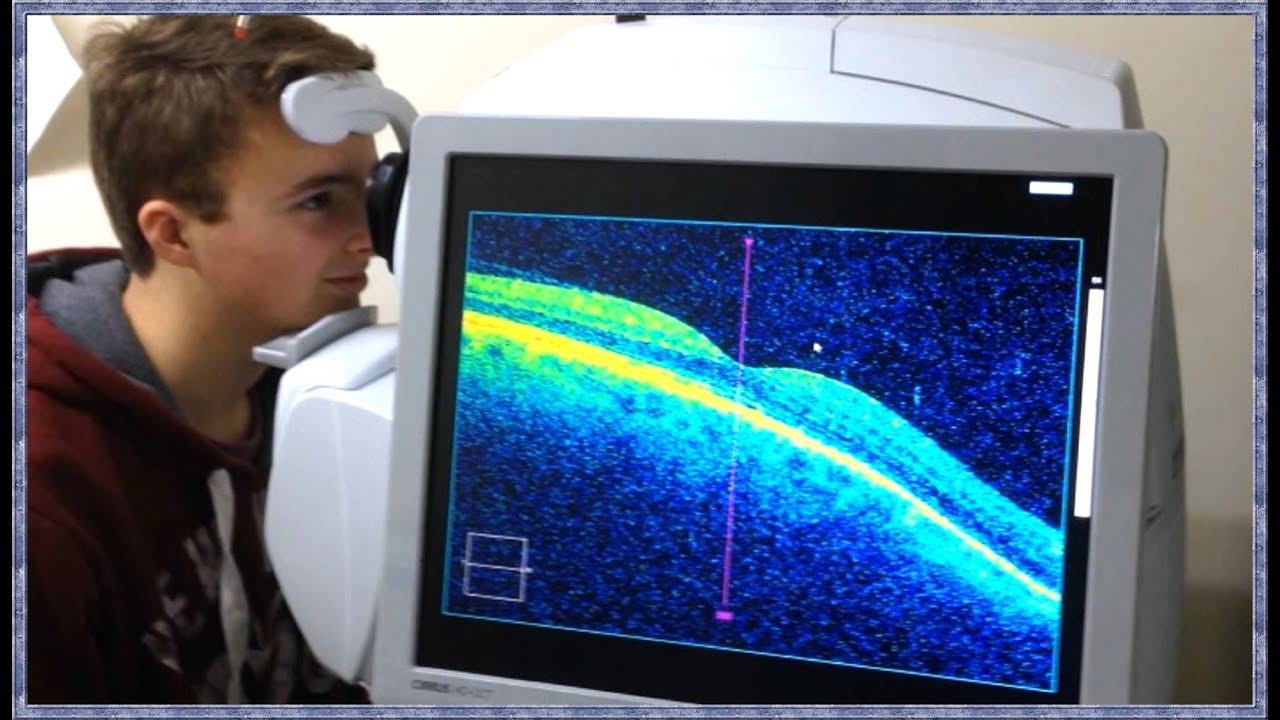
Le plus grand hôpital ophtalmologiste d’Europe possède un scanner ultra performant appelé scanner OCT * (Tomographie en Cohérence Optique ) qui permet de voir la rétine, le fond de l’œil avec la précision d’un microscope cellulaire. Ce genre d’examen permet de diagnostiquer des troubles pouvant engendre la cécité, mais additionné à l'intelligence artificielle, cette imagerie a permis de poser des diagnostiques étonnants sur des pathologies à venir qui n’ont rien à voir avec la vision.
Londres
La capacité d’analyse de ce genre d’imagerie requière une formation très pointue et donc très longue. Il a fait appel à Deep Mind / Google afin de pouvoir s'en remettre à ce système élaboré pour analyser cette imagerie. Et il s'est avéré que le système a été performant au-delà des compétences humaines actuelles. Le système a pu définir le sexe de la personne d'abord à 75% puis à 90% ! Alors même que nous ignorions que les yeux contenaient des caractéristiques de genre !
Cela a ouvert un nouveau champs de recherche l’oculomics, plusieurs équipes multidisciplinaires qui y travaillent avec passion génèrent une énorme quantité de données utiles, l’oculomics semble avoir le potentiel d’arriver assez rapidement dans les applications cliniques.
Si « l’œil est la lampe du corps » (Matthieu 6:22), alors l’IA est la mèche, l’imagerie rétinienne l’huile qui l’alimente, et l’ocuromique est la lumière de la lampe, bien sûr !
Oculome désigne l’ensemble composite de caractéristiques ophtalmiques macroscopiques, microscopiques et moléculaires associées à la santé et à la maladie. De nombreuses maladies systémiques présentent des changements ophtalmiques, notamment l’hypertension, les prémisses du diabète, des maladies cardiovasculaires, les maladies coronariennes, les maladies inflammatoires systémiques, les maladies rénales, les risques d'AVC...
Ainsi désormais on peut y lire l’âge du patient, on peut y voir les antécédents de tabagisme, la consommation de caféine, le taux d’hémoglobine, la tension artérielle mais aussi un risque de développer une maladie cardiaque ou la maladie d’Alzheimer et plus encore.
Oculomics a aidé à identifier des biomarqueurs rétiniens pour plusieurs neurologiques (sclérose en plaques, maladie de Parkinson, neuromyélite optique, myélite transversale longitudinalement étendue, hypertension intracrânienne idiopathique, migraine et compression chiasmale), la maladie cœliaque ...
Dans le domaine psychiatriques (schizophrénie, dépression, trouble bipolaire), cardiovasculaires (facteurs de risque systémiques individuels associés aux maladies cardiovasculaires et aux maladies coronariennes), hématologiques (drépanocytose, thalassémie, leucémie), nutritionnelle (carence en vitamine B12 et D), respiratoire (apnée obstructive du sommeil), auto-immune (polyarthrite rhumatoïde, lupus érythémateux disséminé, maladie de Bechet), infectieuse (virus de l’immunodéficience humaine) et rénale, et toxicité médicamenteuse (éthambutol, chloroquine, plomb, déféroxamine, sildénafil et tamoxifène, etc.).
La rétine est directement accessible de façon non invasive en temps réel de la structure microvasculaire et de la fonction du système nerveux central.
Les biomarqueurs sont définis comme des paramètres objectifs qui aident à prédire, évaluer ou diagnostiquer une maladie et planifier un traitement préventif. La convergence des mégadonnées, de l’intelligence artificielle (IA) et de l’ocuomique et leur intégration ont contribué à rendre les biomarqueurs suffisamment fiables et reproductibles pour être utilisés dans des applications cliniques.
La principale force motrice dans le processus d’oculomics a été le développement et le raffinement de la tomographie par cohérence optique (OCT) et de l’octanagraphie (OCTA), sur la base desquelles des « empreintes rétiniennes » spécifiques peuvent être générées.
Ce nouveau champs de recherche, l’oculomix, pour évoluer demande toujours plus de données médicales à croiser à travers l'Intelligence Artificielle.
* L’origine de l’OCT remonte aux années 1980, lorsque Adolf Fercher a utilisé l’interférométrie en lumière blanche pour imager les tissus oculaires, suivie par le développement par Naohiro Tanno de la tomographie par réflectance hétérodyne en 1990 et l’invention du terme OCT tel que nous le connaissons aujourd’hui par David Huang en 1991.
L’évolution de la technologie OCT du domaine temporel au domaine spectral en passant par la source balayée a entraîné une meilleure qualité d’image, une meilleure résolution axiale et une meilleure vitesse d’acquisition. Une mesure quantitative fiable de l’épaisseur a été rendue possible grâce au traitement d’image et à la segmentation en couches. L’OCT a révolutionné la compréhension, le diagnostic et la prise en charge de l’ensemble du spectre des maladies de la rétine et s’est imposé comme l’un des outils d’imagerie les plus fréquemment utilisés en ophtalmologie.
Développé comme une extension de l’OCT en utilisant le contraste de mouvement pour détecter le flux sanguin, et disponible dans le commerce depuis 2014, OCTA permet la visualisation de la microvascularisation rétinienne résolue en profondeur in vivo.
La segmentation des données volumétriques facilite l’identification individuelle des plexus capillaires rétiniens en haute résolution et améliore la visualisation du plexus capillaire profond et de la choroïde. Des détails spécifiques de la structure rétinienne et de la microvascularisation générées par l’OCT et l’OCTA et leur corrélation avec les maladies systémiques ont aidé à établir plusieurs biomarqueurs rétiniens pour la santé systémique. Certains des développements récents tels que l’OCT Doppler pour mesurer le flux sanguin rétinien, l’OCT de longueur d’onde visible, l’imagerie hyperspectrale du fond d’œil et l’oxymétrie rétinienne ont contribué à une meilleure compréhension des biomarqueurs rétiniens. L’application de l’apprentissage profond, de l’apprentissage profond sans code et des réseaux de neurones convolutifs aux informations dérivées de l’imagerie rétinienne a considérablement amélioré la vitesse d’identification des biomarqueurs, leur sensibilité et leur spécificité.
Sources :
Votre santé, un trésor très convoité | ARTE
Pour ceux qui n'ont pas encore lu
les-gafam-s-emparent-du-marche-juteux-de-la-sante
ne le manquez pas ! Cet article contient des informations encore peu connues !
Pour soutenir le blog, et diffuser les connaissances, n'oubliez pas de partager !
Inscrivez-vous au site
Soyez prévenu par email des prochaines mises à jour
Rejoignez les 1948 autres membres